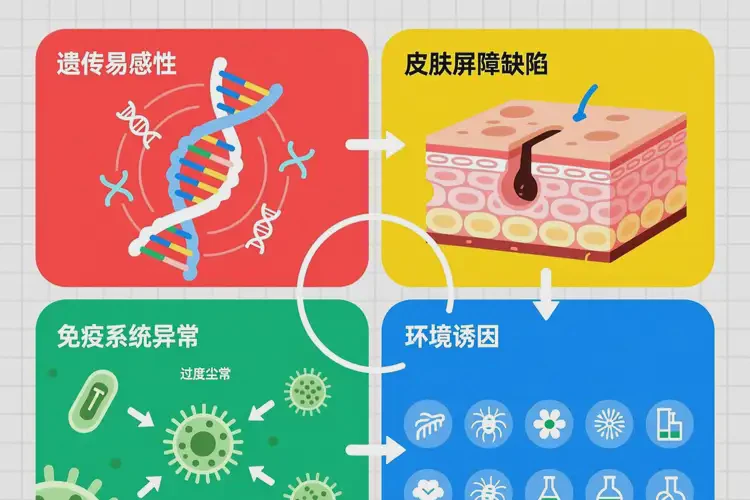
湿疹的发病机制涉及遗传易感性、皮肤屏障缺陷、免疫系统异常及环境诱因四大核心因素共同作用。
湿疹,医学上常称为特应性皮炎(Atopic Dermatitis),是一种慢性、复发性、炎症性皮肤病,其根本成因并非单一,而是多因素交互作用的结果。个体是否发病,取决于基因背景是否赋予易感性、皮肤屏障是否完整、免疫反应是否过度激活,以及是否暴露于特定环境触发因素。这些要素相互交织,形成一个复杂的病理网络,导致皮肤出现瘙痒、红斑、渗出、结痂或苔藓样变等典型表现。
一、遗传与个体易感性
家族聚集性显著
若父母一方患有湿疹、哮喘或过敏性鼻炎等特应性疾病,子女患病风险增加2-3倍;若双方均有,风险可高达50%-70%。这表明遗传因素在湿疹发病中起奠基作用。关键基因突变
FLG基因(编码丝聚蛋白)突变是最明确的遗传风险因素。丝聚蛋白是维持角质层结构与保水能力的关键蛋白,其缺失会导致皮肤屏障功能严重受损,水分流失增加,外界过敏原和刺激物更易穿透。特应性体质
患者常伴有血清IgE水平升高、嗜酸性粒细胞增多等免疫特征,提示其免疫系统对常见环境抗原(如尘螨、花粉)产生异常Th2型免疫应答,进一步驱动炎症反应。

二、皮肤屏障功能障碍
结构完整性破坏
健康皮肤的角质层如同“砖墙结构”(角质细胞为砖,脂质为灰浆)。湿疹患者此结构紊乱,神经酰胺、胆固醇和游离脂肪酸比例失衡,导致“灰浆”松散,屏障“漏水”。经皮水分丢失(TEWL)
屏障受损使经皮水分丢失率显著升高,皮肤干燥、脱屑,进而诱发瘙痒,搔抓又进一步破坏屏障,形成“瘙痒-搔抓-炎症”恶性循环。微生物定植增加
屏障缺陷使金黄色葡萄球菌(S. aureus)更易在皮肤表面定植。该菌可分泌毒素(如δ-毒素),直接激活肥大细胞,加剧炎症与瘙痒。
三、免疫系统异常激活
Th2免疫通路主导
在急性期,IL-4、IL-13、IL-31等Th2型细胞因子大量释放,促进IgE产生、嗜酸性粒细胞浸润,并直接刺激神经末梢引发剧烈瘙痒。慢性期免疫模式转变
随着病程延长,Th1、Th17、Th22通路亦被激活,导致皮肤增厚、苔藓化等慢性改变。IL-22可抑制角质形成细胞分化,进一步削弱屏障。天然免疫失调
表皮中的朗格汉斯细胞和树突状细胞对过敏原呈递异常活跃,而抗菌肽(如LL-37)表达下降,削弱了皮肤对病原体的防御能力。
四、环境与外部诱因
不同诱因对湿疹的影响存在显著差异,下表对比常见触发因素的作用机制与临床意义:
诱因类别 | 具体示例 | 作用机制 | 对疾病的影响程度 |
|---|---|---|---|
物理刺激 | 干燥气候、过度清洁、热水洗澡 | 破坏脂质层,加剧TEWL | ⭐⭐⭐⭐(高) |
化学刺激 | 香精、防腐剂、洗涤剂 | 直接损伤角质细胞,诱发接触性刺激 | ⭐⭐⭐(中高) |
过敏原 | 尘螨、花粉、动物皮屑 | 通过受损屏障进入,激活Th2免疫反应 | ⭐⭐⭐(中高) |
微生物 | 金黄色葡萄球菌、马拉色菌 | 毒素激活炎症通路,生物膜阻碍治疗 | ⭐⭐⭐⭐(高) |
心理因素 | 压力、焦虑、睡眠不足 | 通过神经-内分泌-免疫轴放大炎症反应 | ⭐⭐(中) |
饮食 | 牛奶、鸡蛋、坚果(儿童为主) | IgE介导的速发型过敏或非IgE介导的迟发型反应 | ⭐(低-中,因人而异) |
湿疹并非简单的“皮肤过敏”,而是一种由基因决定、屏障缺陷启动、免疫异常放大、环境因素触发的系统性皮肤疾病。理解其多维成因,有助于患者和家属科学管理诱因、坚持屏障修复、合理使用抗炎治疗,从而有效控制病情,减少复发。早期干预皮肤屏障功能,尤其在婴幼儿期,可能显著降低疾病进展风险。
